Ce este emfizemul pulmonar? Răspunsul specialistului

Dr. Olimpia Nicolaescu MD, PhD
Medic primar pneumolog
Medic specialist hematologie clinică
Doctor in științe medicale cu teza "Contribuții la studiul complicațiilor infecțioase pulmonare in sindroamele limfoproliferative maligne", Universitatea de Medicină Și Farmacie "Dr. Carol Davila", 1997
În anul 2001, Iniţiativa Globală pentru Bolile Pulmonare Obstructive Cronice (Global Initiative for Chronic Obstructive Lung Disease, engl.GOLD) a lansat primul său raport, Strategia globală pentru diagnosticul, tratamentul şi profilaxia bronhopneumatiei obstructive cronice (BPOC), bazat pe datele de patogenie existente la acel moment. Într-o perioadă de peste 20 ani multe dintre aceste date s-au schimbat, inclusiv definiţia bolii (emfizemul pulmonar), această strategie necesitând repetate revizuiri.
Definiţia modernă a BPOC, aşa cum a fost formulată de societăţile comune, americană şi europeană de pneumologie, este cea a unei afecţiuni frecvente, care poate fi prevenită şi tratată, ce se caracterizează prin limitarea persistentă a fluxului de aer, de regulă progresivă, datorată unor modificări la nivelul căilor aeriene și alveolelor. Limitarea fluxului de aer este de regulă cauzată de expunerea la o serie de particule toxice şi gaze, în principal la fumatul de ţigarete, și influențată de dezvoltarea anormală a plămînului gazdei. Comorbiditățile semnificative asociate au și ele un impact important asupra mortalității și morbidității prin această boală.
Limitarea fluxului de aer este cauzată pe de o parte de boala căilor aeriene mici şi pe de alta de distrucţia parenchimului pulmonar (emfizemul), contribuţia celor două componente fiind diferită de la individ la individ. Emfizemul este un termen anatomo-patologic, utilizat cel mai des incorect în practica clinică şi care descrie numai una dintre modificările structurale prezente la bolnavii cu BPOC. Din acest motiv, din punct de vedere clinic ele nici nu pot fi tratate ca entități separate, ci sunt incluse împreună în entitatea recunoscută azi de toți specialiștii în pneumologie de BPOC.
Emfizemul pulmonar: Factori de risc
Fumatul. Fumatul rămâne şi azi de departe cel mai important factor de risc pentru BPOC peste tot în lume. Fumătorii de ţigarete prezintă o prevalenţă mai mare a simptomelor respiratorii şi a modificărilor pulmonare funcţionale, o rată mai mare de declin a volumului expirator maxim pe secundă (VEMS) cu vârsta, precum şi o mortalitate mai ridicată prin BPOC decât nefumătorii. Expunerea pasivă la fumatul de ţigarete reprezintă deasemeni un factor de risc pentru BPOC, ca urmare a creşterii cantităţii de gaze şi particule inhalate. Expunerea copiilor la fumatul maternal conduce la o semnificativă reducere a dezvoltării plămânului. In utero, expunerea la tabac a fătului contribuie deasemenea la o importantă reducere a funcţiilor pulmonare postnatal.
Sexul, vârsta, condițiile socio-economice. Boala are o frecvenţă mai mare la bărbaţi decât la femei precum şi o prevalenţă mai mare la persoanele cu un nivel socio-economic mai scăzut şi cu greutate scăzută la naştere. Prevalenţa bolii a crescut în ultimii ani la adulţii tineri şi la femei, ca urmare a creșterii obiceiului de a fuma și la aceste grupe de populație. Este o boală costisitoare din punct de vedere economic, consumând peste jumătate din bugetul alocat bolilor respiratorii în Uniunea Europeană.
Infecţiile respiratorii. Infecţiile respiratorii în copilărie sunt apreciate ca un potenţial factor predispozant pentru eventuala apariţie a bolii. Infecţiile la adult nu sunt probabil responsabile de iniţierea bolii, dar au un rol semnificativ în menţinerea şi în producerea excerbărilor.
Astmul bronșic și hiperreflectivitatea bronșică, bronșita cronică
- Tendinţa la bronhoconstricţie ca răspuns la o varietate de stimuli exogeni, este una dintre caracteristicile definitorii ale astmului. Totuşi, şi unii pacienţi cu BPOC prezintă acest tip de răspuns, fapt ce face ca separarea clinică dintre astm şi BPOC să nu fie deloc uşoară, cu atât mai mult cu cât şi cca 20% dintre astmatici dezvoltă în timp o bronhoobstrucţie ireversibilă. Hiperreflectivitatea bronşică reprezintă în acest context, la bolnavii cu BPOC, un factor de risc independent pentru declinul funcţiilor pulmonare.
- Definiţiile precedente ale BPOC, ce separau „emfizemul” de „bronşita cronică” nu mai intră în caracterizarea actuală a bolii conform GOLD. Bronşita cronică, sau prezenţa tusei productive cel puţin 3 luni timp de 2 ani consecutiv, este de regulă o afecţiune independentă, care poate să preceadă sau să urmeze limitării fluxului aerian, contribuind la agravarea acestuia. În acest sens, bronşita cronică poate fi prezentă şi la bolnavii cu spirometrie normală.
Expunerea profesională. Unele ocupaţii specifice incluzând expunerea la praf, pulberi, vapori, iritanţi, gaze cum ar fi: praful de cărbune, siliciu, cadmiu, dejecte animale, expunere la solvenţi, precum şi munca în industria bumbacului şi a materialelor de construcţie, constituie factori de risc pentru bronhoobstrucţia cronică. Acestui tip de expunere, subapreciată o vreme, i se atribuie astăzi 10-20% dintre cazuri.
Poluarea atmosferică şi casnică. Este mai mare în urban decât în rural. Sursele de poluare pot fi: produşi de combustie (petrol, gaz, kerosen, cărbune, lemn), materiale de construcţie (mobilier din produşi de lemn presat, izolările de azbest), covoarele ude sau umede, produşi de curăţire sau de întreţinere, sisteme de încălzire, răcire sau umidificare, surse ca radonul, pesticidele sau aerul poluat din exterior.
Factorii genetici. În ciuda unei puternice asocieri etiologice între fumat şi BPOC, numai 15-20% dintre fumători prezintă o scădere a VEMS care să poată fi considerată în cadrul BPOC. Acest fapt sugerează că susceptibilitatea la efectele fumatului este determinată genetic. Până în momentul de faţă însă, deficitul de alfa1-antitripsină (a1AT), constituie singurul factor de risc genetic identificat în mod cert, deşi există studii în desfăşurare care încearcă să determine şi să probeze şi alte modificări genetice posibil implicate.
Emfizemul pulmonar: Anatomie patologică și fiziopatologie
Scăderea fluxului aerian, modificarea fiziologică majoră din BPOC, este urmarea atât a obstrucţiei căilor aeriene mici, cât şi a emfizemului. Emfizemul şi boala căilor aeriene mici sunt prezente împreună la majoritatea persoanelor cu BPOC, şi contribuţia lor diferenţiată la obstrucţie variază de la o persoană la alta. Obstrucţia căilor aeriene mici se întâlneşte mai degrabă la debutul bolii, în timp ce emfizemul predomină în formele cu evoluţie îndelungată.
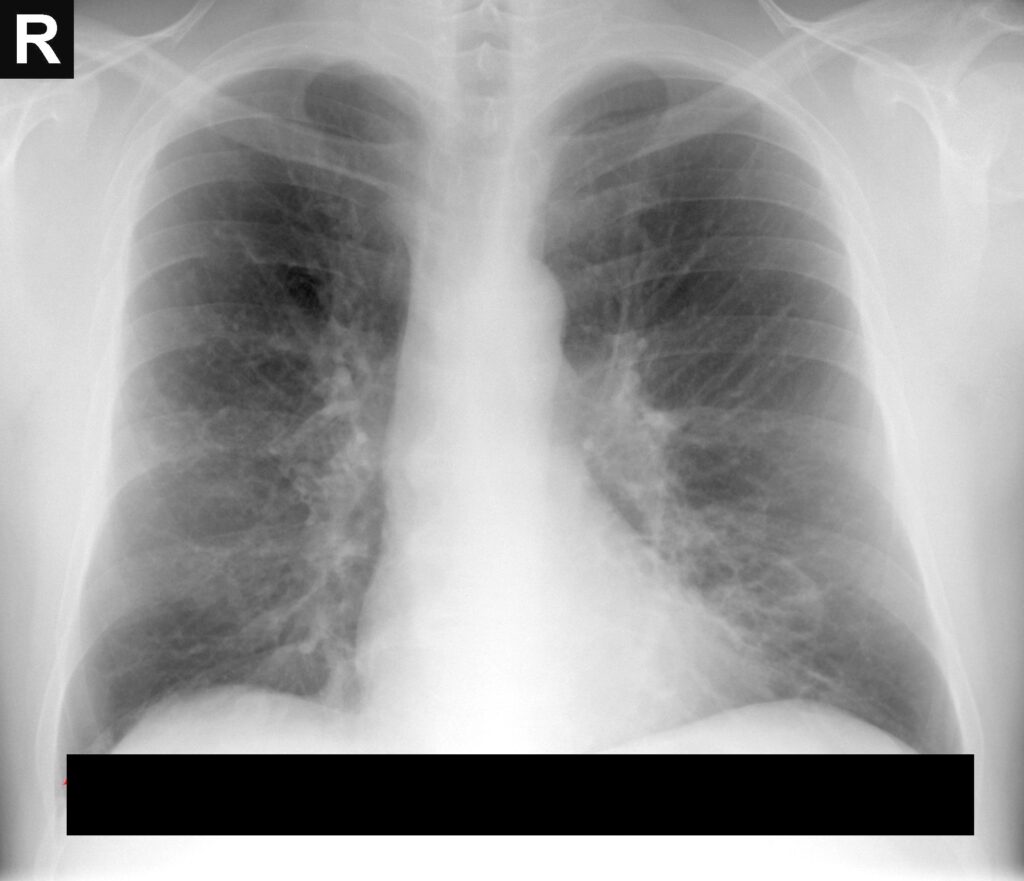
Emfizemul se defineşte prin distrugerea suprafeţei de schimb gazos: bronhiole respiratorii, ducturi alveolare, alveole. Se întâlneşte sub două variante: emfizemul centriacinar şi emfizemul panacinar.
- Emfizemul centriacinar (centrilobular)afectează părţiile centrale sau proximale ale acinilor, în timp ce alveolele distale sunt cruţate. Se localizează mai frecvent în lobii superiori, în special în segmentele apicale cu posibilitatea existenţei de mari bule apicale. Pereţii spaţiilor emfizematoase conţin frecvent pigmenţi negri şi inflamaţia este prezentă în jurul bronhiilor, bronhiolelor şi în septuri. Se întâlneşte la marii fumători, ades în asociere cu bronşita cronică.
- Emfizemul panacinar (panlobular)este mai frecvent în lobii inferiori, şi mai sever la baze. Acinii sunt uniform lărgiţi, începând de la nivelul bronhiolelor respiratorii, prefixul pan- referindu-se la întregul acin, nu la întregul plămân. Macroscopic plămânii sunt voluminoşi, hiperinflaţi, putând ascunde cordul. Este asociat cu deficitul de a1AT.
Limitarea fluxului aerian reprezintă markerul fiziologic al modificărilor din BPOC. Mecanismele implicate sunt primordial ireversibile (distrugerea suprafeţei de schimb gazos), cu o redusă componentă reversibilă. Curgerea aerului la nivelul căilor aeriene periferice este rezultanta echilibrului care se stabileşte între reculul elastic, ce promovează curgerea, şi rezistenţa căilor aeriene, care o limitează. În BPOC, scăderea reculului elastic datorată distrucţiilor alveolare, alături de creşterea rezistenţei la flux în căile aerifere mici, care sunt îngustate şi colabate, conduc la scăderea debitului de aer. Consecințele fiziopatologice ale limitării fluxului de aer sunt reprezentate de:
- hiperinflația pulmonară cu creșterea volumelor pulmonare;
- modificări ale gazelor sângelui, cu scăderea presiunii parțiale și a saturației oxigenului în sânge (hipoxemie) și creșterea, de regulă tardivă, apărută numai în obstrucțiile severe, a presiunii parțiale a bioxidului de carbon (hipercapnie);
- hipertensiunea pulmonară, care, pe lângă distrucțiile parenchimatoase din emfizem, cu pierderea de vase pulmonare mici, are și alte mecanisme: vasoconstricţia pulmonară hipoxică, acidemia, hipercapnia, efectele mecanice ale volumelor pulmonare mari asupra vaselor pulmonare;
- cordul pulmonar cronic se defineşte drept hipertrofia şi dilatarea ventriculului drept ca urmare a hipertensiunii pulmonare cronice secundare BPOC, însoţită sau nu de insuficiență ventriculară dreaptă.
Emfizemul pulmonar: Diagnostic pozitiv
Istoric. Evoluţia clinică a BPOC se caracterizează printr-o progresie lentă şi relativă stabilitate punctată de exacerbări periodice ce au o frecvenţă variabilă de la un bolnav la altul. Pacienţii sunt de regulă în jur de 50 de ani, predominant bărbaţi, cel mai ades cu un lung istoric de fumat, cel puţin un pachet/zi de cel puţin 20 de ani şi prezintă, în grade variabile, dispnee, tuse cronică însoţită sau nu de expectoraţie.
- Dispneea este progresivă şi se agravează în timp, persistentă (prezentă în fiecare zi), descrisă de către bolnav ca „o creştere a efortului de a respira”, „greutate”, „sete de aer” sau „gâfâială”, se agravează în cursul efortului fizic şi al infecţilor respiratorii.
- Tusea cronică este prezentă intermitent la debut sau zilnic în formele mai avansate, cel mai ades pe parcursul întregii zile, rar numai noaptea, ades sub forma „tusei matinale a fumătorului”, însoţită sau nu de expectoraţie.
- Producţia cronică de spută poate avea orice aspect, de la sputa mucoidă la cea mucopurulentă, prezentă mai ales în exacerbările infecţioase.
- Semnele şi simptomele extratoracice sunt: cefaleea matinală – marker al retenţiei de CO2, scăderea ponderală care în cazurile avansate corelează cu un prognostic rezervat, anxietatea, depresia, tulburări ale somnului.
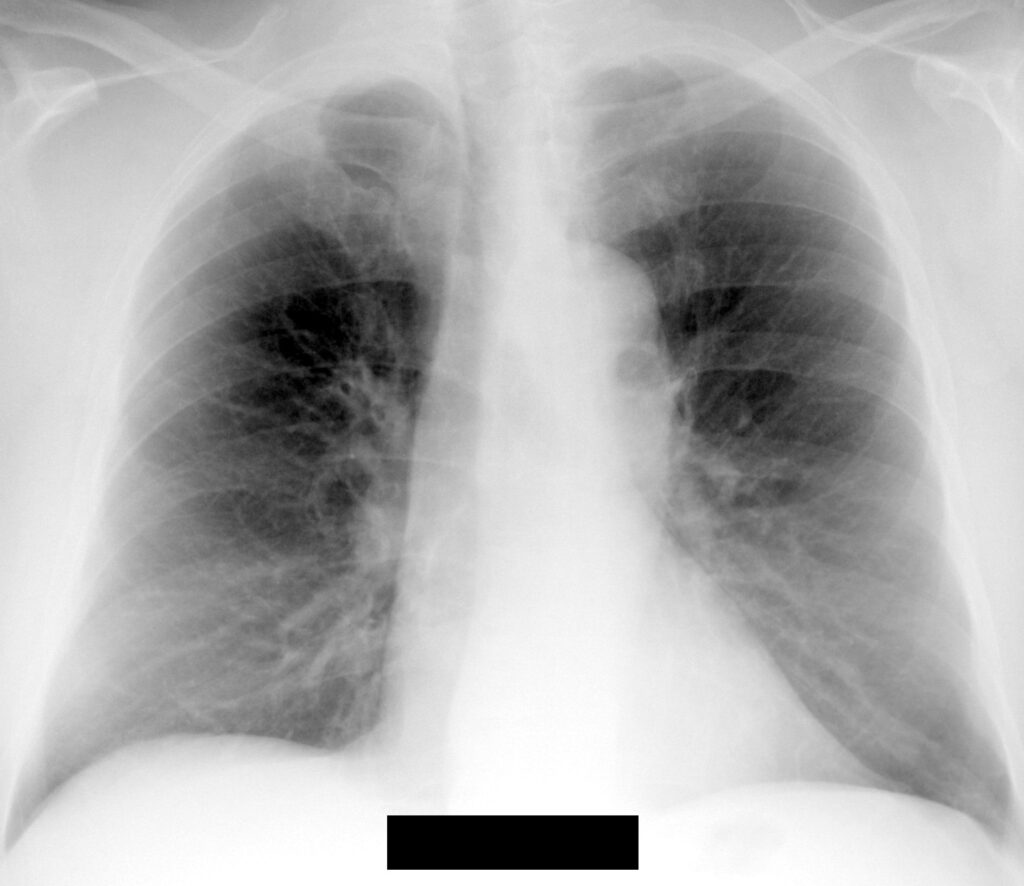
Semne fizice. Bolnavul poate prezenta:
- expir prelungit cu apropierea buzelor în expir,
- diminuarea murmurului vezicular şi raluri bronşice, în special la baze,
- semne de hiperinflaţie – mărirea diametrului antero-posterior toracic, orizontalizarea coastelor, retracţia inspiratorie a marginilor coastelor inferioare, asurzirea zgomotelor cardiace,
- pacientul îşi utilizează musculatura respiratorie accesorie: sternocleidomastoidienii, scalenii şi muşchii intercostali,
- în stadii mai avansate de boală, pacienţii pot prezenta semne cardiace de cord pulmonar cronic și de hipertensiunea pulmonară, semne de stază venoasă (edeme la nivelul membrelor inferioare, hepatomegalie de stază, turgescenţa venelor jugulare),
- cianoza este evidenţiabilă la nivelul buzelor şi al patului unghial, în caz de hipoxemie severă şi eritrocitoză.
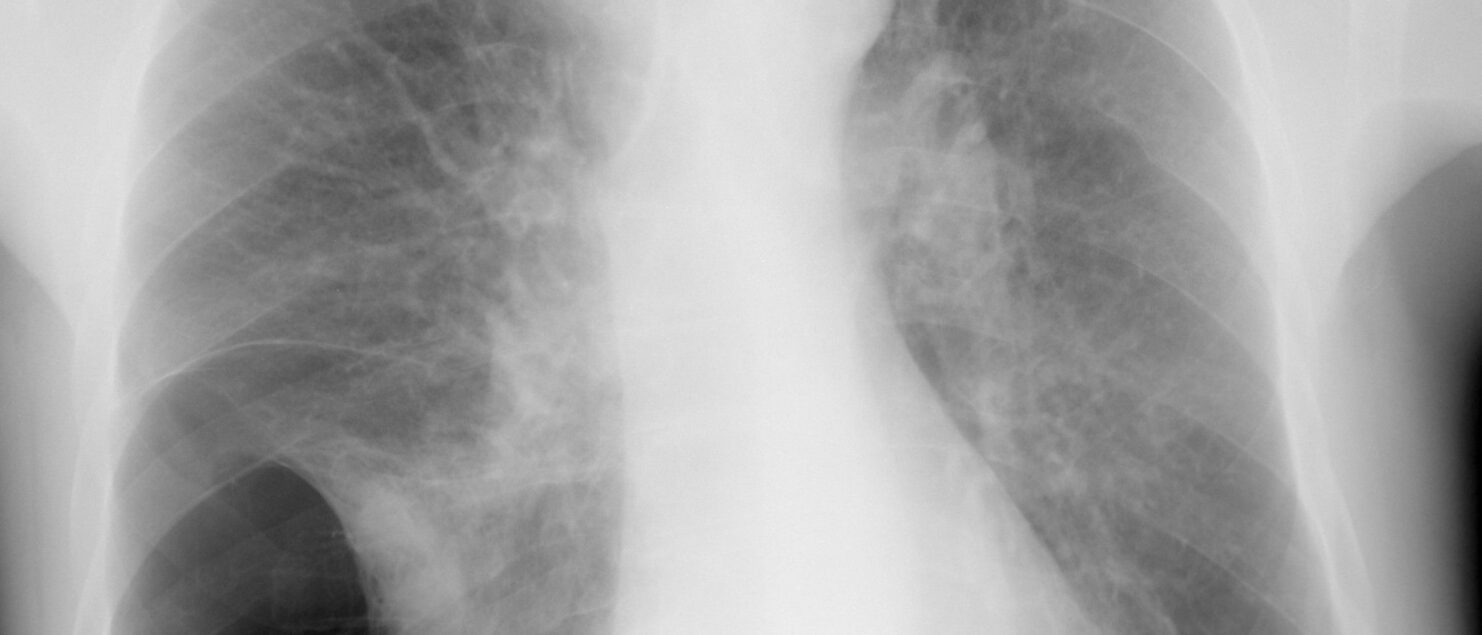
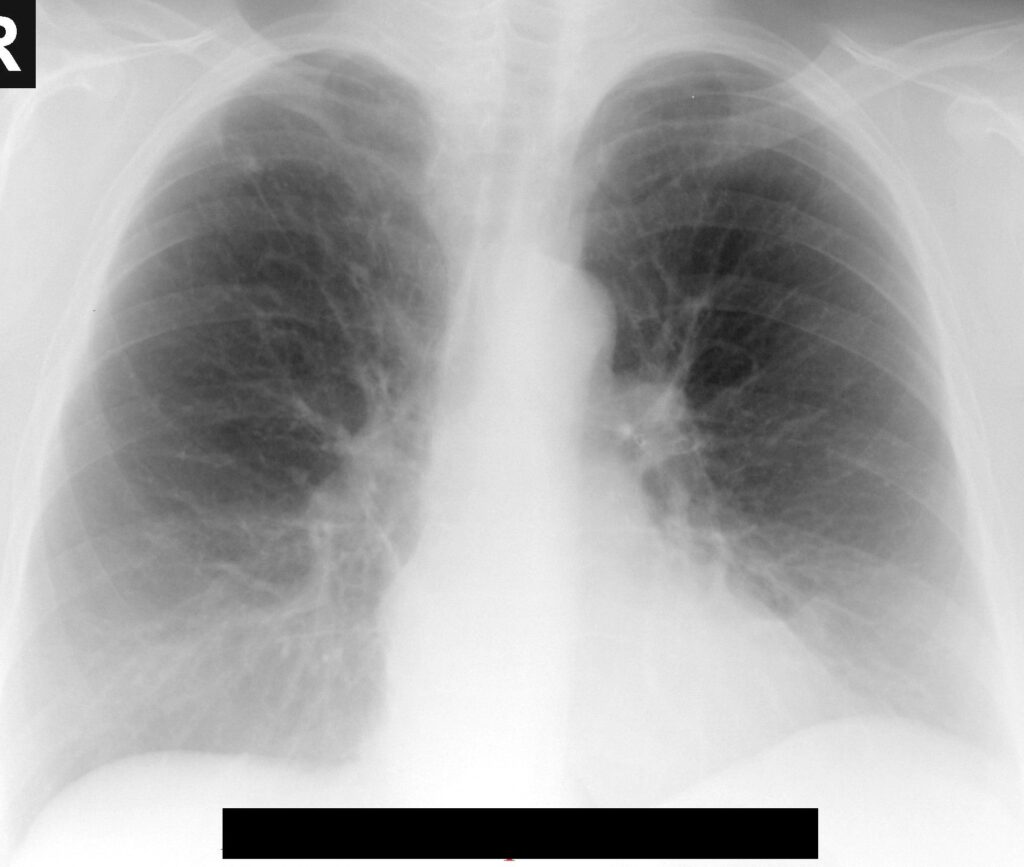
Radiografia pulmonară poate fi normală în stadiile iniţiale. În stadiile avansate modificările radiologice sunt expresia emfizemului, hiperinflaţiei şi hipertensiunii pulmonare: creşterea difuză a transparenţei pulmonare, reducerea desenului vascular, prezenţa de bule (hipertransparenţe circumscrise, cu d > 1 cm şi pereţii subţiri), coborârea diafragmului. În stadii avansate apar semne de hipertensiune pulmonară, dilatarea ventriculului drept cu insuficiență ventriculară dreaptă în stadii târzii.
Probe funcţionale ventilatorii. Spirometria reprezintă cea mai accesibilă metodă de a măsura în mod obiectiv şi repetat limitarea fluxului de aer. O spirometrie de calitate este posibilă în orice unitate sanitară şi toţi cei care îngrijesc pacienţi cu BPOC trebuie să aibă acces la spirometrie. Pentru diagnosticul de BPOC se măsoară capacitatea vitală forţată (volumul de aer expirat complet şi forţat după o inspiraţie maximă – CVF), volumul expirator maxim pe secundă (volumul de aer care poate fi expirat forţat în prima secundă după o inspiraţie maximă şi forţată – VEMS) şi se calculează raportul dintre ele. Măsurătorile spirometrice sunt evaluate prin comparare cu valori de referinţă în funcţie de vârstă, înălţime, sex şi rasă. Raportul VEMS/CV < 0,7 defineşte BPOC.Spirometria se efectuează la 10-15 min după administrarea unui bronhodilatator cu durată scurtă de acţiune (de regulă b2-adrenergic), pentru a reduce la minim variabilitatea.
Pulsoximetria este utilizată pentru a evalua saturaţia în oxigen a pacientului şi necesitatea oxigenoterapiei. Se vor monitoriza în acest mod toţi pacienţii stabili cu VEMS < 35% din prezis sau cu semne sugestive de insuficienţă respiratorie ± insuficienţă cardiacă dreaptă.
Gazele sanguine arteriale nu sunt indicate ca parte a unei evaluări de rutină pentru pacienţii cu forme uşoare şi medii de boală. Pentru majoritatea bolnavilor, pulsoximetria se dovedeşte suficientă pentru a aprecia saturaţia oxigenului. Determinarea gazelor sanguine arteriale poate fi de ajutor pentru aprecierea hipoxemiei, dar mai ales a hipercapniei, în special la persoanele cu forme severe de boală sau în cursul exacerbărilor. Valoarea gazelor sanguine arteriale tinde deasemeni să se înrăutăţească în cursul efortului fizic şi în timpul somnului.
Emfizemul pulmonar: Exacerbări, complicaţii şi comorbidităţi
Exacerbarea este definită ca un eveniment acut caracterizat prin înrăutăţirea simptomelor respiratorii ale pacientului ce depăşeşte variaţiile zilnice ale acestora şi care conduce la modificarea medicaţiei. Exacerbările sunt evenimente importante în cursul evoluţiei bolii deoarece afectează în mod negativ calitatea vieţii pacienţilor, necesită săptămâni pentru recuperare, accelerează rata de declin a funcţiilor pulmonare, sunt asociate cu o mortalitate înaltă, mai ales pentru cei care necesită spitalizare, au costuri socio-economice ridicate. Cauze de exacerbare:
- cea mai frecventă cauză o reprezintă infecţiile virale şi bacteriene ale tractului respirator,
- cauze mai rare, cauze ce pot fi considerate în acelaşi timp drept comorbidităţi: pneumonia, pneumotoraxul şi pleureziile, tromboembolismul pulmonar, insuficienţa cardiacă, aritmiile, unele medicamente – tranchilizante, sedative, diuretice, b-blocante.
Numeroase complicaţii, cu grade variabile de severitate pot greva evoluţia acestor bolnavi:
- pneumoniile,
- caşexia,
- poliglobulia (mecanism compensator al hipoxiei),
- tromboembolismul pulmonar,
- pneumotoraxul spontan ce rezultă din ruperea de bule emfizematoase aflate aproape de suprafaţa plămânului,
- cordul pulmonar cronic,
- sindromul de apnee de somn,
- complicaţiile generate de:
- medicaţie (metilxantine, simpaticomimetice, corticoterapie),
- tulburările metabolice (hipercapnie, acidoză, hipopotasemie, alcaloză metabolică),
- manevre exploratorii sau terapeutice (aspiraţia traheală, spirometria, bronhoscopia).
Comorbidităţi ce pot avea un impact semnificativ asupra prognosticului:
- bolile cardio-vasculare (ischemia coronariană, aritmiile, hipertensiunea arterială),
- osteoporoza,
- depresia,
- diabetul,
- boala de reflux gastro-esofagian,
- cancerul bronho-pulmonar – are aceeaşi etiologie majoră – fumatul, şi este o importantă cauză de inoperabilitate şi deces.
Tratament
Abandonarea fumatului reprezintă strategia cu cel mai mare impact asupra istoriei naturale a BPOC. Strategiile curente pentru renunţarea la fumat includ mijloacele nefarmacologice şi farmacologice.
- Strategiile nefarmacologice sunt reprezentate de voinţa proprie, sfatul medicului, materiale educative, terapie comportamentală, terapie alternativă. Mesajul medicului trebuie să fie clar, consecvent, personalizat, şi însoţit de exemplul personal (!). Toate acestea trebuie susținute de o legislație fermă de reglementare a consumului de tutun.
- Mijloacele farmacologice cuprind două grupe de medicamente: tratament cu produşi de substituţie ai nicotinei (TSN) şi tratament non-nicotinic.
- În cadrul TSN, persoana care încearcă să întrerupă fumatul primeşte nicotina temporar, într-o formă pură, care nu aduce concomitent şi ceilalţi compuşi ai unei ţigări, pentru a reduce simptomele de sevraj care constituie obstacolul major în reuşita debarasării de acest obicei. Nicotina este administrată sub formă de gumă, plasture transdermic, inhalator, spray nazal, tabletă sublinguală. Țigareta electronică, ce oferă o doză controlabilă inhalatorie de nicotină, are o eficacitate controversată deoarece pe lângă nicotină conține și alte substanțe chimice ale căror efecte nu sunt încă bine cunoscute și controlate.
- Produşii non-nicotinici (bupropionul, vareniclina, nortriptilina), sunt utilizaţi mai degrabă într-un program complex de abandonare a fumatului decât în monoterapie.
Bronhodilatatoarele reprezintă medicaţia de elecţieîn terapia BPOC-ului simptomatic şi cu obstrucţie evidenţiabilă clinic.
- Se folosesc toate cele trei tipuri de bronhodilatatoarecunoscute (b2-agonişti, anticolinergice, teofiline), alegerea între aceste trei grupe de bronhodilatatoare sau o terapie combinată depinzând de disponibilul de medicamente, precum şi de răspunsul individual în termeni de ameliorarea a simptomelor.
- Se prescriu:
- la nevoie, sau cu administrare regulată pentru a preveni sau reduce simptomele,
- se preferă cele cu durată lungă de acţiune,
- combinaţia dintre ele poate să amelioreze eficacitatea şi să scadă riscul efectelor adverse comparativ cu creşterea dozelor unui singur bronhodilatator.
- Se preferă terapia inhalatorie (aerosoli dozaţi, nebulizare). Sistemele de distribuire a medicaţiei inhalatorii sunt: dispozitive de tip spray, folosind un gaz vehicul al substanţei şi dispozitive cu pulbere, de tip diskhaler, turbuhaler sau rotahaler. Sistemele cu pulbere sunt preferate faţă de cele tip spray, deoarece elimină necesitatea coordonării inspirului cu acţionarea dispozitivului, pacientul trebuind doar să inspire puternic din dispozitiv.
Glucocorticoizii. Există numeroase controverse pe plan mondial privind tratamentul cu corticosteroizi în BPOC-ul stabil, efectele lor în BPOC fiind mult mai modeste comparativ cu utilizarea lor în astmul bronşic.
- Corticosteroizii inhalatori, în special dacă sunt asociați cu bronhodilatatoarele cu durată lungă de acțiune, ameliorează simptomele, funcţia pulmonară și calitatea vieţii. Ei pot fi utili pentru bolnavii stabili la care determină reducerea gravităţii exacerbărilor şi a numărului de internări precum şi creşterea toleranţei la efort. Au un efect mai bun în cazurile moderate și severe.
- În cazul corticoizilor orali balanţa între efectele terapeutice şi cele adverse este defavorabilă (pacienţi în vârstă, comorbidităţi). Tratamentul pe termen lung nu este recomandat: nu are efecte benefice dovedite, apar efecte adverse serioase (osteoporoză, fracturi vertebrale) şi miopatia cortizonică agravează insuficienţa respiratorie. Se recomandă utilizarea lor doar în exacerbări, iar tratamentul cronic este nerecomandat.
Inhibitorii de fosfodiesterază-4 (roflumilast).Reprezintă o medicaţie cu administrare unică zilnică, care, deşi nu are o activitate bronhodilatatoare proprie, potenţează efectul bronhodilatatoarelor cu durată lungă de acțiune pe VEMS când este administrat concomitent cu aceştia. În combinaţie cu glucocorticoizii contribuie la ameliorarea exacerbărilor moderate şi severe.Cele mai frecvente efecte adverse sunt: greaţa. anorexia, durerile abdominale, diareea, insomnia şi cefaleea. Acestea sunt mai frecvente la începutul tratamentului, sunt reversibile şi diminuă în timp. Roflumilastul nu se va utiliza concomitent cu teofilina iar la pacienţii depresivi se va administra cu prudenţă.
Mucoliticele și agenții anti-oxidanți (N-acetilcisteina, carbocisteina, erdosteina). Pentru pacienții care nu primesc glucocorticoizi, tratamentul regulat cu mucolitice precum N-acetilcisteina și carbocisteina are un efect modest asupra ratei exacerbărilor și asupra stării de sănătate. Spre deosebire de acestea, s-a demonstrat că erdosteina ar putea avea un efect semnificativasupra formelor medii de exacerbare, indiferent dacă este asociată sau nu cu glucocorticoizii. Datorită heterogenicității populațiilorr studiate, nu există încă date exacte privind grupurilețintă pentru acest agent terapeutic.
Tratamentul deficitului de a1ATcu a1AT exogenă derivată din plasmă umană se indică bolnavilor peste 18 ani, cu un nivel al a1AT sub 11 mmol/l, care au abandonat fumatul şi care au un VEMS între 35-49% din prezis. Se administrează intravenos în doză săptămânală de 60 mg/kg. Preţul ridicat îi limitează indicaţiile şi nici nu este disponibil în multe ţări.
Oxigenoterapia pe termen lung(> 15 h/zi)
- Efecte
- creşterea duratei de supravieţuire prin prevenirea agravării hipertensiunii pulmonare și a cordului pulmonar cronic,
- ameliorarea toleranţei la efort, a somnului şi a performanţelor cognitive,
- combaterea policitemiei secundare şi a tendinţei la caşexie.
- Evaluarea gazelor arteriale este metoda preferată pentru determinarea necesarului de oxigen, incluzând informaţii de bază. Saturaţia arterială a oxigenului se măsoară prin pulsoximetrie (SpO2) care este şi o metodă adecvată pentru monitorizare.
- Obiectivul terapeutic al oxigenoterapieieste de a menţine SpO2 ³ 90% în cursul repausului, efortului fizic şi al somnului.
- Indicaţiiile oxigenoterapiei în BPOC stabil sunt:
- SpO2 £ 88% indiferent de nivelul capniei (bioxid de carbon în sânge),
- SpO2 ³ 89% dar cu semne de hipertensiune pulmonară sau policitemie secundară (Hematocrit> 55%),
- SpO2 ³ 90% dar cu hipoxie în cursul efortului sau al somnului.
- Sursa de oxigen include gaz sau lichid comprimat, concentrator de oxigen, livrat bolnavului prin intermediul unei canule nazale, la un debit de 2-5 l/min. Sursa poate fi staţionară, la domiciliul bolnavului, şi portabilă, atunci când activitatea bolnavului impune deplasarea lui.
Reabilitarea pulmonară reprezintă un program multidisciplinar de îngrijire al pacienţilor respiratori care este individualizat şi organizat astfel încât să poată optimiza performanţele sociale şi fizice şi să confere autonomie pacientului. Se adresează tuturor bolnavilor deficienţi respiratori dar în principal celor cu BPOC. El este un proces multidisciplinar şi implică diferiţi specialişti: pneumolog, cardiolog, medic de familie, medic recuperaţionist, fiziokinetoterapeut, nutriţionist, psiholog. Un astfel de program durează minim 6 săptămâni; cu cât programul este mai prelungit, cu atât rezultatele sunt mai bune şi mai de durată.
Obiectivele programului de reabilitare sunt:
- diminuarea simptomelor (împreună cu mijloacele farmacologice),
- îmbunătăţirea calităţii vieţii (capacitatea de a interacţiona cu mediul şi cu societatea),
- reantrenarea la efort,
- corectarea stării nutriţionale,
- optimizarea performanţelor psihice şi sociale.
Recuperarea propriu zisă constă în:
- Exerciţiu fizic. Tipurile de exerciţii pe care bolnavii trebuie să le efectueze sunt: de forţă, de rezistenţă, tehnici de tuse dirijată, modalităţi de dozare a efortului, drenaj secreţii. Atunci când bolnavul nu poate participa la un astfel de program instituţionalizat, i se poate recomanda, cu efecte bune, să se plimbe 20 min/zi.
- Sfaturi privind nutriţia. Scăderea ponderală şi în particular epuizarea musculară contribuie în mod semnificativ la morbiditate, invaliditate şi handicap la bolnavii cu BPOC. Scăderea ponderală şi pierderea ţesutului adipos sunt rezultanta unei balanţe negative între aportul alimentar şi energia consumată, în timp ce epuizarea musculară este consecinţa unei balanţe negative între sinteza de proteine şi consumul acestora. În stadii avansate ale BPOC, ambele balanţe sunt afectate, impunând un supliment caloric adecvat ± anabolizante.
- Educaţia. Programul educaţional trebuie să includă:
- sfaturi privind abandonarea fumatului,
- informaţii de bază asupra bolii.
- deprinderi de auto-analiză a semnelor şi simptomelor pentru a putea lua decizii personale asupra tratamentului atât în timpul excerbărilor, cât şi al perioadelor de stabilitate, fapt ce necesită însă ca bolnavului să i se explice şi să cunoască bine medicaţia care îi este administrată,
- strategii care să îl ajute la ameliorarea dispneii,
- când să solicite ajutorul,
- cum să întârzie evoluţia bolii.
Eficienţa reabilitării se apreciază prin:
- ameliorarea calităţii vieţii şi reducerea dispneii,
- combaterea depresiei şi a marginalizării,
- reducerea ratei exacerbărilor/spitalizărilor,
- creşterea speranţei de viaţă.
Profilaxie
- Studiile mai vechi stipulau că utilizarea continuă a antibioterapiei nu aduce niciun beneficiu în ceea ce priveşte frecvența exacerbărilor. Studii mai noi au arătat însă că utilizarea regulată a unor antibiotice ar putea reduce rata exacerbărilor. Li s-au atribuit acest efect Azitromocinei și Eritromicinei care, administrate timp de un an, intermitent, au redus riscul exacerbărilor.
- Se indică vaccinarea antigripală, vaccinarea cu vaccin anti-pneumococic și vaccinarea anti-COVID-19 pentru bolnavii cu BPOC.
Transplantul se indică bolnavilor cu insuficiență respiratorie severă şi hipertensiunea pulmonară secundară. Limitările acestei proceduri sunt date de:
- numărul redus de donatori,
- bolnavii trebuie să fie sub 65 de ani şi să nu prezinte comorbidităţi renale, hepatice şi cardiace,
- complicaţiile, altele decât mortalitatea operatorie (rejecţia acută, bronşiolita obliterantă, infecţiile – CMV, Candida, Aspergillus, Cryptococcus, Pneumocystis carinii, Psudomonas, specii de Stafilococ), limfoame,
- costurile foarte ridicate.
Chirurgia de reducere a volumului pulmonar este o procedură chirurgicală prin care o parte din plămân este rezecată.
Rezultatele acestei intervenţii sunt:
- reducerea hiperinflaţiei,
- îmbunătăţirea funcţiilor diafragmului,
- creşterea reculului elastic al parenchimului rămas şi a fluxului aerian cu 25-50%,
- creşterea capacităţii de efort.
Se indică bolnavilor cu BPOC formă severă GOLD, sub 75 de ani, cu hiperinflaţie şi dispnee accentuată în ciuda tratamentului medical optim.
Limitele şi contraindicaţiile sunt reprezentatea de: statusul de fumător activ, obezitate marcată sau caşexie, inabilitatea de a urma un program de reabilitare post-operator, beneficii pe o durată limitată de 1-3 ani, după care dispneea reapare şi VEMS-ul continuă să scadă, mortalitate post-operatorie mare 5-18%, cost ridicat.